中空纤维生物反应器是检查特定药物剂量对细胞影响的卓越工具
抗生素耐药性的出现对全球健康构成了明显的威胁。抗生素药物效应可能既取决于时间和浓度,静态模型也无法提供有关最有效剂量曲线的数据,也无法揭示随着时间的推移出现耐药性。在可以模拟人类生物利用度和药物动力学的体外模型中,还没有有效的工具来检测抗生素的时间和浓度的影响。病原菌耐药菌株的出现要求为抗生素研究提供新工具。
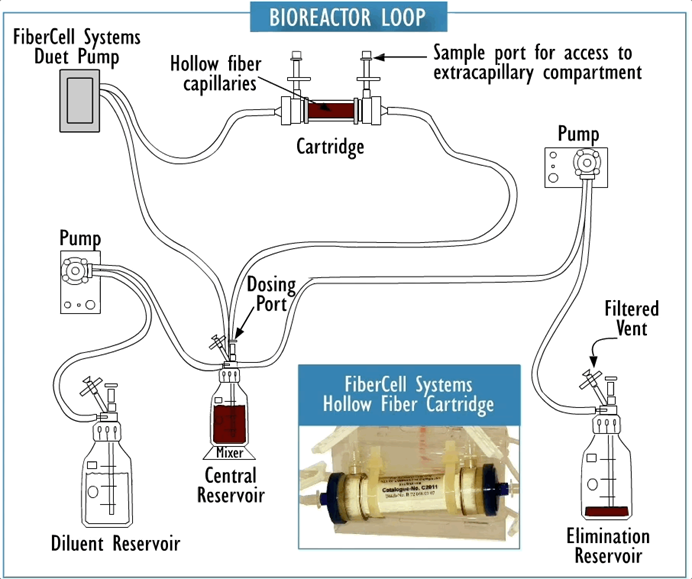
FiberCell中空纤维双室模型为您提供了优于单室模型、静态模型和动物模型的优势。下图显示了中空纤维双室模型。测试生物体保留在中空纤维柱中。中央储液罐不断地再循环培养液。将药物添加到中央储液器中,并通过向中央储液器中添加稀释剂来控制消除动力学。中央储液罐中的体积保持恒定。
目前用于确定抗生素疗效的测定也无法检查产生耐药性的可能性,因为抗生素耐药性会随着时间的推移而发展。精确模拟人类 pk/pd 的动态模型控制药物浓度随时间的变化,将弥合静态分析、动物模型和临床试验之间的差距。还需要一种时间相关的测定,能够检查抗生素药代动力学对足够大的生物种群的影响,以揭示耐药性的出现。
两室模型的设计与单室模型非常相似,只是要测试的生物体被限制在 ECS 内,通过半透膜与中央储层物理隔开。中央储液器中的药物浓度与含有生物体的 ECS 中的培养基迅速平衡。中央储液器的体积可以调节,以允许药物浓度的快速变化。中空纤维滤芯具有极高的表面积体积比,超过 150 cm2每毫升体积,可在 ECS 内提供药物的快速均匀分布。市面上有几种不同类型的中空纤维聚合物,可以与不同化学成分的药物兼容。
中空纤维盒的横截面。测试生物体保留在纤维外的小体积中,而培养液和药物则通过纤维内部循环。药物等小分子可以与营养物质和废物一起自由穿过纤维,而细菌和细胞则无法穿过纤维。
中空纤维与单室模型相比的优势
-
细菌载量保持不变
-
生物危害性得到安全控制
-
吸收和消除曲线都可以建模
-
可以对快速半衰期进行建模

中空纤维与静态模型相比的优势
-
目标细菌在非常小的体积内,因此药物可以在隔室内快速平衡
-
可以轻松采集代表性样本,而不会显著影响细菌种群
-
耐药性、高致病性和高度生物危害性生物被安全地封闭在密封环境中
-
一次实验可检测大量生物体
-
被测药物的吸收和消除动力学都可以精确和独立地控制
-
还可以控制多种药物的动力学,因此可以很容易地检查药物/药物相互作用和联合疗法

中空纤维与动物模型的优势
-
可以测试高细菌和病毒载量,导致耐药性的剂量曲线更有可能被揭示出来
-
吸收、排泄和代谢特征可以更紧密地根据人类半衰期进行建模
-
可以对极端剂量进行建模
-
可以轻松控制和测试联合疗法
-
更便宜
-
针对病原体的封闭式生物安全系统
-
更容易用同一药物检测多种病原体
-
每个实验的 N 值更大(串联的柱)
-
可以检测细菌、病毒、癌症和寄生虫
-
可以更精确地控制剂量和代谢概况
如果您需要同时测试两种药物的影响,可以使用 FiberCell 2 药物 HFBR 模型。
参考文献
-
Comparison of in vitro static and dynamicassays to evaluate the efficacy of an antimicrobial drug combination againstStaphylococcus aureus: Broussou, D. et al; PLOS ONE Jan 2019 [openaccess]
-
Clinical Regimens of Favipiravir InhibitZika Virus Replication in the Hollow-Fiber Infection Model:Camilly P. Pires deMello et al.; Antimicrob Agents Chemother 2018 62 [abstract]
-
Differential Activity of the Combination ofVancomycin and Amikacin on Planktonic vs. Biofilm-Growing Staphylococcus aureusBacteria in a Hollow Fiber Infection Model: Broussou, D. et al; Front.Microbiol., 27 March 2018 [openaccess]
-
Optimization and evaluation of piperacillinplus tobramycin combination dosage regimens against Pseudomonas aeruginosa forpatients with altered pharmacokinetics via the hollow-fiber infection model andmechanism-based modelling: Yadav, R. et al; AMS 2018 (62) 3 [abstract]
-
Evaluation of Activity and Emergence ofResistance of Polymyxin B and ZTI-01 (Fosfomycin for Injection) againstKPC-Producing Klebsiella pneumoniae: Diep, J.K. et al; Antimicrob. AgentsChemother. 2018 (62) 2 [openaccess]
-
Oseltamivir-zanamivir combination therapysuppresses drug-resistant H1N1 influenza A viruses in the hollow fiberinfection model (HFIM) system: Pires de Mello, C.P.; European Journal ofPharmaceutical Sciences 111 (2018) 443-449 [open access]
-
Polymyxin Combinations Combat Escherichiacoli Harboring mcr-1 and blaNDM-5: Preparation for a PostantibioticEra. Bulman Z.PP; mBio 8(4)2017 [openaccess]
-
In vitro pharmacodynamic evaluation ofceftolozane/tazobactam against β-lactamase-producing Escherichia coli in ahollow-fibre infection model Soon, R et al. International Journal ofAntimicrobial Agents 2017 49(1)[open access]
-
From lead optimization to NDA approval fora new antimicrobial: Use of pre-clinical effect models andpharmacokinetic/pharmacodynamic mathematical modeling. Drusano G.L.;Bioorg Med Chem. 2016[abstract]
-
Linezolid for Infants and Toddlers WithDisseminated Tuberculosis: First Steps: Deshpande, D. et al.; Clin InfectDis. 2016, 63 (3)S80-87 [abstract]
-
Concentration-Dependent Synergy andAntagonism of Linezolid and Moxifloxacin in the Treatment ofChildhood Tuberculosis: The Dynamic Duo: Deshpande, D. et al.;Clin Infect Dis. 2016, 63 (3): S88-S94.[open access]
-
A Faropenem, Linezolid, and Moxifloxacin Regimen for Both Drug-Susceptible and Multidrug-ResistantTuberculosis in Children: FLAME Path on the Milky Way: Deshpande, D. et al.;Clin Infect Dis. 2016, 63(3): S95-S101.: S88-S94.[open access]
-
Thioridazine as Chemotherapy forMycobacterium avium Complex Diseases: Deshpande, D. et al.; Antimicrob.Agents Chemother. 2016 60 (8) 4652-4658 [open access]







