体外血管生成三维培养模型构建-应用指南
血管生成介绍
introduction

血管生成(Angiogenesis)是从原有的血管出芽形成新生血管的过程,在许多生理和病理过程中起重要作用,例如肿瘤生长和转移、炎症等。血管生成微环境对于开发针对这些病理的疗法至关重要,内皮细胞可以从静止状态转变为血管生成状态,导致迁移,这在常规 2D 培养方法中难以检测到。重要的是,缺乏精确模拟这种具有可调性质的细胞外基质(ECM)的体外模型,以深入了解这种微环境条件。
目前血管生成的研究高度依赖于天然ECM(如Matrigel),其具有不可调的水凝胶组成成分和性质。这种传统方法只允许对培养基中的生长因子或抑制剂进行实验,不支持关于ECM的某些特性如何影响血管生成的研究。因此,非常需要具有可调血管生成微环境的可靠人类血管生成模型,以增加我们对于内皮细胞相关的病理学的理解。这种先进的模型可以提供关于内皮细胞如何经历形态变化或与邻近细胞相互作用以响应某些刺激影响血管生成的新信息,并增加我们对血管疾病、中风、高血压等病理生理学的理解。

TheWell提供两款VitroGel血管生成试剂盒:
✦ VitroGel Angiogenesis Assay Kit(即用型体外血管生成试剂盒):VitoGel AAK(货号:VHM06-K),具有固定的水凝胶机械强度,含有不同的生长因子添加物来调节水凝胶内的生长因子;
✦ VitroGel Angiogenesis Assay HC Kit(高浓度体外血管生成试剂盒):AAK-HC(货号:TWG011-K),具有可调的高浓度水凝胶,可以完全控制水凝胶的机械强度和生长因子添加物来调节水凝胶内的生长因子。
以下实验数据与结果皆来源于TheWell实验室。
我们使用即用型VitroGel Angiogenesis Assay Kit和高浓度VitroGel Angiogenesis Assay HC Kit来证明水凝胶特性修饰对人脐静脉内皮细胞(HUVEC)血管生成检测的影响。
实验从2D水凝胶包被培养方法开始,其中我们在细胞培养板底部从VitroGel AAK制备了一层厚厚的水凝胶,并将HUVEC细胞接种在水凝胶层的顶部。HUVEC血管生成对不同的水凝胶组成(血管内皮生长因子(VEGF)阳性,VEGF阴性或无生长因子)表现出显著差异,即使使用相同的内皮细胞完全培养基,也显示不同的管腔结构和血管形成。另一方面,我们能够通过使用VitroGel AAK-HC来调节水凝胶浓度。数据表明,除了基质内的生长因子外,机械性能还会严重影响细胞活力和管形成 - 由于依赖于天然ECM的传统实验的限制,这种影响以前是未知的。当HUVEC被包裹在水凝胶中时,同样的观察结果可以进一步扩展到3D细胞培养。
结果显示水凝胶的可调节性和机械强度以及使用VitroGel水凝胶的最佳浓度,培养时间和3D血管结构形成的影响。我们证明生长因子不仅存在于培养基中,而且存在于水凝胶本身中,显著影响管的形成。用无异源可调节的VitroGel水凝胶系统代替天然ECM,研究人员能够研究微环境的物理、化学、生物学特性与细胞行为之间的关系。
简而言之,两种体外水凝胶血管生成试剂盒是研究人员探索血管生成的强大工具。我们希望这些试剂盒能助力研究人员和研究团队建立复杂的组织模型,以提升药物筛选过程、细胞侵袭测定以及内皮细胞和血管生成的疾病相关研究。

材料和方法
一、细胞培养
二、调节水凝胶性能
三、2D水凝胶包被培养
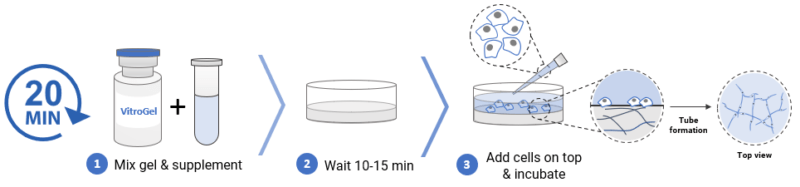
✦ 01、将 1 mL 水凝胶溶液加入 500 μL AAK Supplement 1 中,轻轻上下颠倒 5-10 次以充分混匀。
注意:保持VitroGel AAK溶液和AAK Supplement 1的混合比例为2:1(v / v)。
✦ 02、将 50 μL 水凝胶混合物转移到 96 孔板中。轻轻旋转孔板以确保均匀覆盖孔底部。
✦ 03、室温下静置10-15分钟以形成软凝胶。
注意:在此期间,不要摇晃孔板干扰软凝胶的形成。
✦ 04、小心地将 50 μL 细胞悬液添加到凝胶顶部。在 37°C 下孵育。
✦ 05、将细胞在37°C孵育,每隔一天更换50-80%的顶部培养基。
四、3D培养
✦ 01、在AAK Supplement 1中制备细胞悬液。推荐的细胞浓度为 1-2 x106细胞/mL。
✦ 02、将 1 mL 水凝胶溶液添加到上一步的 500 μL 细胞悬液中。轻轻上下颠倒 5-10 次以彻底混匀,将水凝胶和细胞悬液保持在 2:1 (v/v) 的比例。
✦ 03、将 50 μL 水凝胶混合物转移到 96 孔板中。轻轻旋转孔板以确保均匀覆盖每个孔的表面。
✦ 04、室温下静置10-15分钟以形成软凝胶。
注意:在此期间,不要摇晃孔板干扰软凝胶的形成。
✦ 05、小心地在孔顶部添加 50 μL 额外培养基以覆盖水凝胶。
✦ 06、置于37°C的培养箱中孵育,每隔一天更换50-80%的顶部培养基,以免影响培养板中的水凝胶状态(或根据实验设计更换覆盖培养基)。

五、荧光成像
对于荧光成像,将细胞固定并用Actin Green和NucBlue染色,以标记F-actin以及细胞核。 详细步骤如下:
六、结果和讨论

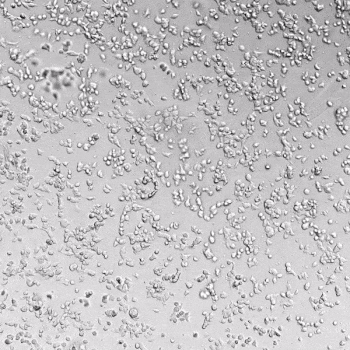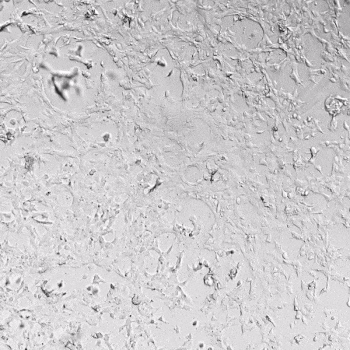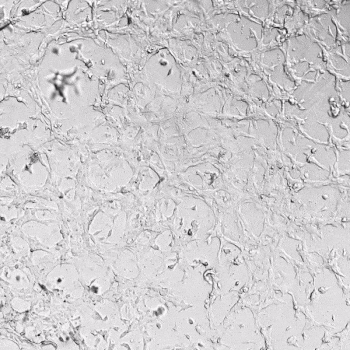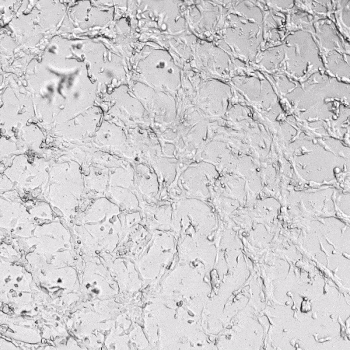
图1. VitroGel AAK水凝胶顶部内皮细胞的血管生成

图2. HUVEC细胞在VitroGel AAK水凝胶(A)/VitroGel AAK-HC水凝胶(B)与AAK Supplement 2上的管状形态。将细胞固定并用DAPI(蓝色)和actin green(绿色)染色。
✦ 当使用VEGF阴性添加物(VitroGel AAK Supplement 1)的水凝胶时,在VitroGel AAK和VitroGel AAK-HC水凝胶的两种情况下,HUVEC能够在表面上附着和生长而不会形成管(图3)。图2和图3表明,尽管在两种水凝胶条件下使用了相同的完全培养基,但水凝胶中的VEGF生长因子会显着影响管的形成。
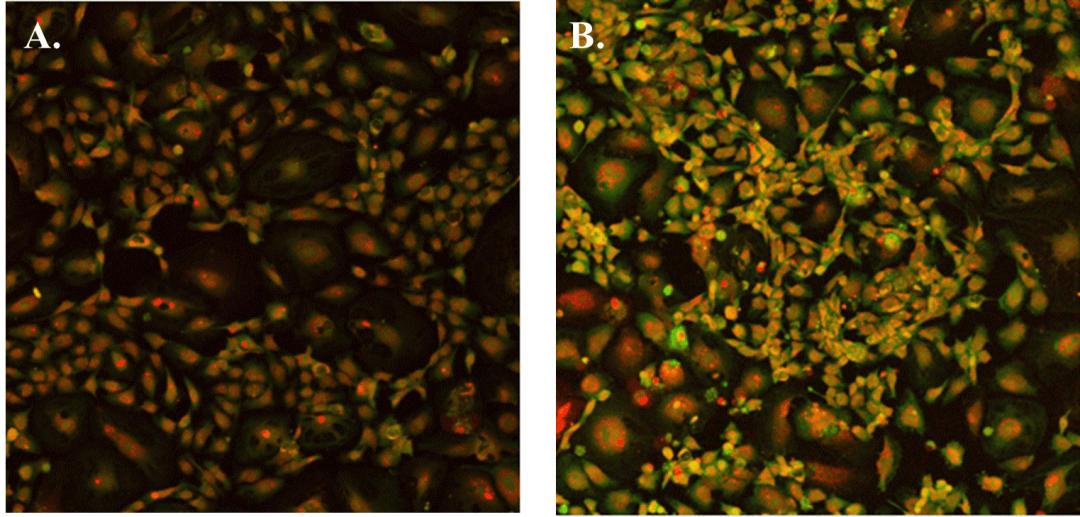
图3.HUVEC细胞在VitroGel AAK水凝胶(A)/VitroGel AAK-HC水凝胶(B)与AAK Supplement 1上的生长形态。将细胞固定并用DRAQ5(红色)和actin green(绿色)染色。
✦ 接下来,我们旨在比较在补充或不补充生长因子的情况下制备的VitroGel AAK水凝胶上的HUVEC生长,以突出生长因子对水凝胶血管生成的影响。在该实验中,在水凝胶顶部使用相同的完整内皮生长培养基进行细胞培养。在图4的不同时间点获得具有VitroGel AAK Supplement 2或不含生长因子的水凝胶顶部的HUVEC细胞生长。图4B和4D显示了在水凝胶表面上生长的细胞,其中不含生长因子添加物,而图4A和4C显示了给予VitroGel AAK-Supplement 2的细胞的图像。
有趣的是,尽管在两种培养条件下都使用了完整的细胞培养基,但与未从水凝胶中补充生长因子的细胞相比,延时视频显示,添加细胞生长因子后,水凝胶中的细胞附着和血管生成有显着改善。
这些图像为水凝胶添加物对HUVEC增殖和活力的益处提供了进一步的证据,因为与接受水凝胶生长因子支持的细胞相比,没有补充生长因子的细胞清楚地显示出更少的管腔结构(图4D红色箭头)。
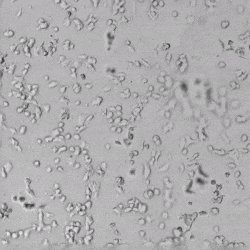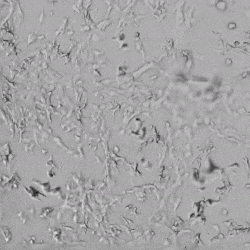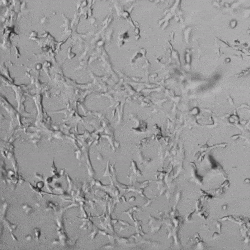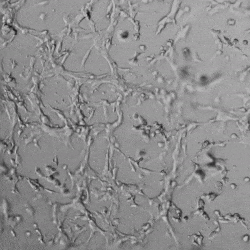
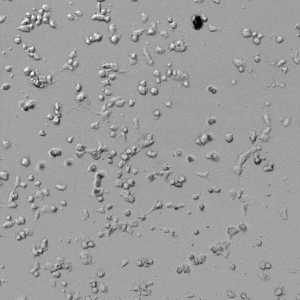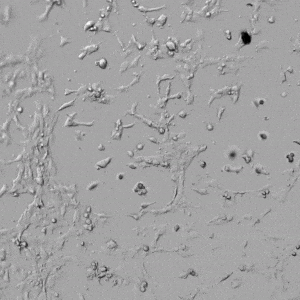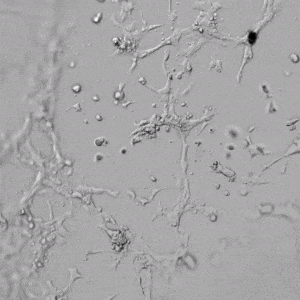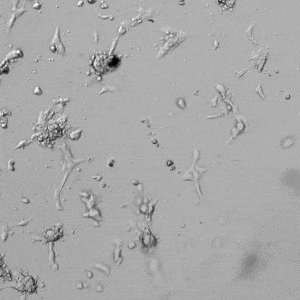
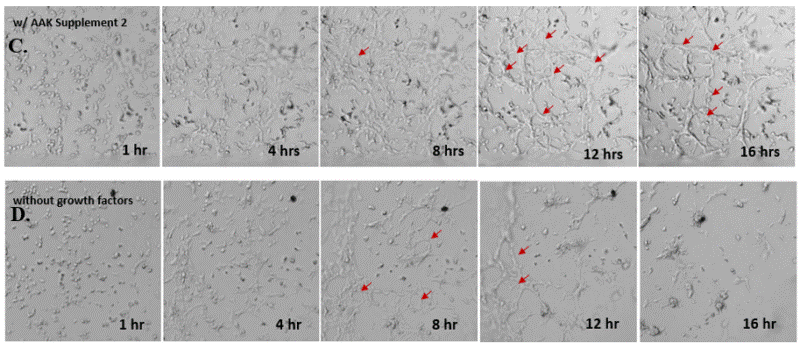
图4.有和没有生长因子添加物的VitroGel AAK水凝胶顶部内皮细胞生长的比较。左上)实时视频显示HUVEC接种在含有VEGF的AAK Supplement 2中培养18小时的血管生成图;右上)实时视频显示没有细胞生长因子的HUVEC接种;C)HUVEC细胞在不同时间点在具有AAK Supplement 2的VitroGel AAK水凝胶顶部生长;D)没有细胞生长因子的不同时间点的HUVEC细胞生长。红色箭头表示管状结构形成。

结
语

|
货号 |
名称 |
描述 |
|
TWG011-K1 |
VitroGel Angiogenesis Assay HC Kit, TYPE 1 |
用于血管形成、侵袭和动物注射的 2D 水凝胶包被和 3D 培养的可调水凝胶系统。 |
|
VHM06-K1 |
VitroGel Angiogenesis Assay Kit - TYPE 1 |
用于血管形成、侵袭和动物注射的 2D 水凝胶包被和 3D 培养的即用型水凝胶系统。 |
参考文献

END 欢迎在文章下给我们留言或分享哦!
往
期
推
荐

联系我们:189 1849 5545(微信)
电话:021-58785545
http://www.xpbiomed.com/
Copy right 2012 by Shanghai XP Biomed Ltd. All Rights Reserved
沪 ICP备12039761号-1 沪ICP备12039761号-2 沪ICP备12039761号-3 沪ICP备13002267号-1